現在、たくさんの薬が開発され、治癒できる病気が増えています。
しかし、中には未だ有効な治療法がなく、命に関わる重篤な疾患も存在し、世界中で、希少疾患や難病に対する治療薬が求められています。
先駆け審査指定制度とは
日本では、世界に先駆けて、有効的な新薬を早期に実用化する動きが進められています。この戦略は「先駆けパッケージ戦略」と呼ばれ、
基礎研究から保険適用、国際展開までを一環として、早期実用化を促進する支援が行われています。
その重点施策の一つが「先駆け審査指定制度」です。
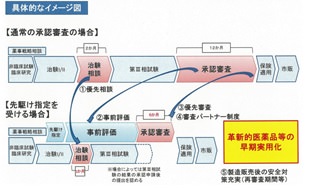
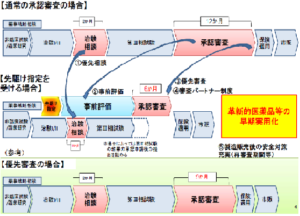
先駆け審査指定制度で審査の期間を短縮
厚生労働省資料より
通常、新薬の審査は12カ月を目標として行われていますが、この制度で指定された医薬品は6カ月を目標に優先的に審査が行われ、承認までの期間が短縮されます。
日本で最初に申請が計画されていること、
非臨床試験・初期の臨床試験において既存の治療法よりも顕著な改善がみられること、
新しい作用機序であること、
対象とされる疾患が重篤であることが指定医薬品に選ばれる条件となります。
2017年4月新たに5品目を指定
厚生労働省は2017年4月、新たに5品目の医薬品を対象品目として指定しました。2015年の胃癌や白血病治療薬等6品目の指定に続き、2回目の先駆け指定になります。
今回対象となったのは、
酸性スフィンゴミエリナーゼ欠乏症、アルツハイマー病の進行、デュシェンヌ型筋ジストロフィー、胆道癌、再発悪性神経膠腫・切除不能な局所再発頭頚部ガン並び局所進行頭頚部ガンに対する治療薬であり、
これら疾患に効果が期待される医薬品です。
この制度は、最新の革新的な医薬品を日本で先に実用化するために設けられています。今後、迅速な審査により、難病で苦しむ人々のもとにいち早く薬が届けられることが望まれます。
参照:厚生労働省


コメント